-
Les différentes formes de spondylarthrite
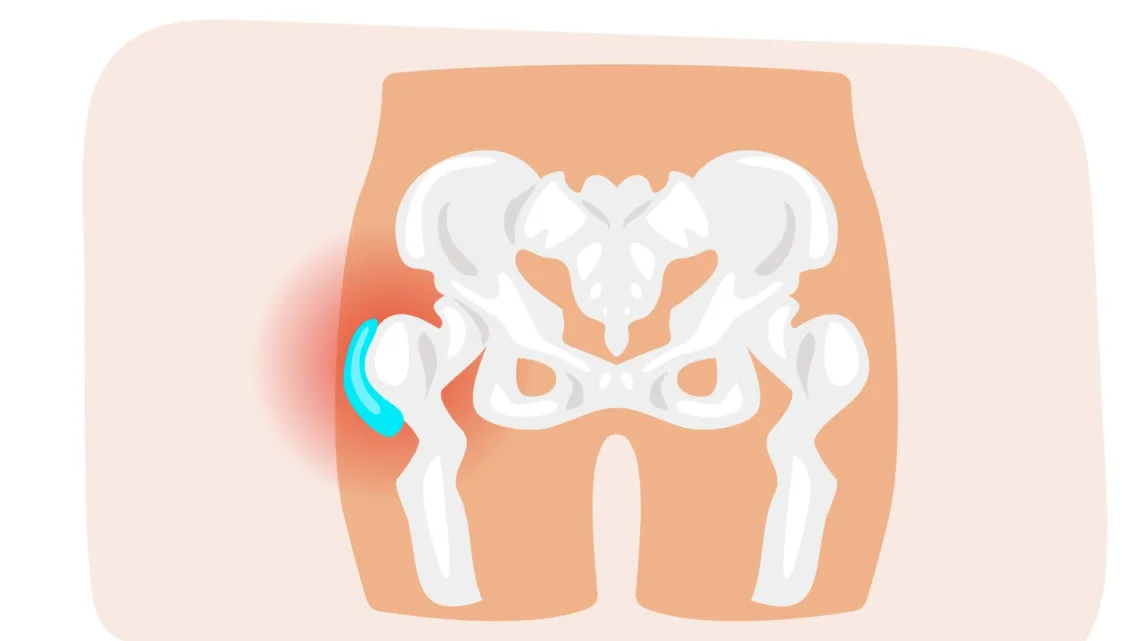
La spondylarthrite est un terme générique qui regroupe plusieurs formes de rhumatismes inflammatoires chroniques. Ces maladies se caractérisent par des douleurs et une inflammation au niveau des articulations, en particulier celles de la colonne vertébrale et du bassin.
-
Les idées reçues sur la spondylarthrite ankylosante
Bien qu'il existe une prédisposition génétique à la spondylarthrite ankylosante (notamment liée au gène HLA-B27), la transmission de la maladie n'est pas systématique.
-
Les différentes formes d’eczéma : comprendre et gérer
L'eczéma est une affection cutanée courante qui peut se présenter sous différentes formes, chacune ayant ses propres causes, symptômes et traitements. En comprenant les spécificités de chaque type d'eczéma et en adoptant des mesures préventives et de gestion adaptées, il est possible de soulager les symptômes et d'améliorer la qualité de vie des personnes touchées.
-
Eczéma dyshidrosique : comprendre et gérer cette affection cutanée
L'eczéma dyshidrosique, une forme d'eczéma affectant les mains et les pieds. Apprenez-en plus sur les symptômes, les traitements, les facteurs génétiques et les professionnels de santé à consulter pour gérer cette affection cutanée.
-
L’eczéma de contact : comprendre et apaiser cette inflammation cutanée
Causes, symptômes et traitements de l'eczéma de contact, une inflammation cutanée provoquée par des substances irritantes ou allergisantes. Apprenez à identifier les facteurs déclencheurs et à prévenir les récidives pour soulager votre peau.
-
Syndrome de Dravet : comprendre pour mieux accompagner
Le syndrome de Dravet est une forme rare et sévère d'épilepsie infantile, caractérisée par des crises convulsives résistantes aux traitements et un retard de développement. Cette maladie génétique touche principalement les enfants en bas âge et représente environ 1 à 2% des épilepsies chez l'enfant.
-
Comprendre l’Emphysème : Symptômes, Causes et Traitements
Tout ce qu'il faut savoir sur l'emphysème, une maladie respiratoire chronique qui touche des millions de personnes dans le monde.
-
BPCO : Bronchopneumopathie Chronique Obstructive
Découvrez tout ce qu'il faut savoir sur la BPCO, une maladie respiratoire chronique qui touche des millions de personnes en France et dans le monde. Apprenez-en plus sur ses symptômes, traitements, facteurs de risque et l'errance diagnostique.
-
L’incidence des allergies sur l’eczéma
L'eczéma est une maladie cutanée inflammatoire chronique qui touche de nombreuses personnes dans le monde.
-
La spondylarthrite ankylosante, symptômes et traitements
La spondylarthrite ankylosante, une maladie inflammatoire chronique qui affecte la colonne vertébrale et les articulations sacro-iliaques. Cet article explique les symptômes, les traitements, les examens à faire, qui consulter et les facteurs et causes liés à la maladie.